La nanomedicina, cioè l'applicazione di nanotecnologia a livello di un miliardesimo di millimetro alla medicina, negli ultimi venti anni ha compiuto passi da gigante, arrivando alla commercializzazione di prodotti di successo sia dal punto di vista clinico sia da quello economico. Entriamo grazie a questo articolo d'approfondimento nel complesso e difficile mercato nanomedicale.
Introduzione

Nanomolecola e relativa scala metrica.
Globalmente definita come l'applicazione di nanotecnologia nell'ambito clinico, la nanomedicina ha le sue radici negli stessi concetti di base e principi della nanotecnologia in generale, cioè in materiali con caratteristiche a nanoscala (n.d.t. Un nanometro corrisponde a un miliardesimo di millimetro) che presentano qualità uniche, altrimenti assenti a livello macroscopico. Proprio come la nanotecnologia beneficia della matematica e dell'ingegneria, anche la nanomedicina ha una natura multidisciplinare che comprende nozioni e tecniche mutuate dalla biologia, dalla chimica e dalla fisica. Come risultato di questo matrimonio ben riuscito, le nanostrutture mostrano funzioni emergenti che hanno eccezionali benefici quando applicati a dispositivi medici.
Il successo della nanotecnologia nel settore sanitario è dovuto alla possibilità di lavorare alla stessa scala di molti processi biologici, meccanismi cellulari e molecole organiche. Per questa ragione, la medicina ha guardato alla nanotecnologia come soluzione ideale per l'individuazione e il trattamento di molte malattie. Una tra le tante applicazioni della nanotecnologia nel settore medico è il campo della somministrazione di farmaci. L'avvento di protocolli e metodi per la sintesi, la funzionalizzazione e l'uso di nanoparticelle e nano-vettori ha inondato la comunità scientifica e clinica con nuovi approcci terapeutici, dalla somministrazione mirata all'ablazione a radiofrequenza, dalle terapie personalizzate alle tecniche minimamente invasive.
Mentre la maggior parte dei membri della comunità d'investimento è in grado di afferrare il significato della nanotecnologia e può lanciare e gestire con perizia un prodotto funzionante sul mercato, essi sono limitati nella loro comprensione concettuale di questa disciplina scientifica e degli intricati meccanismi interni che stanno dietro la funzionalità del prodotto. Al contrario, coloro coinvolti nella ricerca scientifica riconoscono che la nanomedicina è un'espansione della nanotecnologia, ma hanno poca comprensione della competenza finanziaria richiesta per sviluppare la loro tecnologia in un prodotto commerciale. La cooperazione è perciò necessaria tra le due fazioni per condurre invenzioni basate sulla nanomedicina a una posizione di mercato di successo.
Il mercato della nanomedicina
Col 76% delle pubblicazioni e il 59% dei brevetti, la somministrazione di medicinali è il segmento di mercato che domina il settore della nanomedicina. La diagnostica in vitro rappresenta il secondo campo di espansione con l'11% delle pubblicazioni e il 14% delle richieste di brevetto. Secondo la Commissione Europea, in una visione globale, raggruppando le pubblicazioni nelle tre aree geografica USA, Europa e Asia (Giappone, Cina, Sud Corea, Taiwan, Singapore e India) l'Europa conduce col 36% delle pubblicazioni mondiali, seguita dagli USA col 32% e dall'Asia col 18%. Considerando tutte le richieste di brevetto nei differenti campi della nanomedicina, gli USA detengono una quota del 53%, l'Europa del 25% e l'Asia del 12%. Le aziende biofarmaceutiche e di apparecchiature medicali sono ben coscienti delle potenziali applicazioni della nanotecnologia al settore sanitario, com'è dimostrato dal sempre maggiore aumento delle collaborazioni tra queste aziende e le startup nanomedicali.
Secondo un rapporto di ricerca della Business Communications Company1, nonostante le catastrofiche conseguenze della crisi del 2008-2009 sui mercati finanziari, il settore globale della nanomedicina, che era valutato in 53 miliardi di dollari nel 2009, è previsto in aumento a un tasso annuo di crescita composto (CAGR) del 13,5%, fino a sorpassare i 100 miliardi di dollari nel 2014. Uno dei più grandi segmenti di questo mercato è rappresentato dai prodotti anticancro. Valutato in circa 20 miliardi nel 2009, ci si aspetta che raggiunga i 33 miliardi di dollari nel 2014, crescendo a un CAGR dell'11%.
Problemi comuni negli investimenti sull'innovazione
Il primo prodotto dell'innovazione è ottenere il know-how che l'inventore possiede inizialmente. Per sfortuna, la confidenzialità di questa conoscenza può essere violata e il suo uso da parte di un'azienda non può precludere l'uso della stessa da parte di un'altra. Perciò gli investitori che si avvicinano a nuovi progetti devono essere coscienti del fatto che non potranno appropriarsi facilmente dei ricavi totali dell'investimento intrapreso. Come conseguenza, c'è una mancanza di attrattiva nel finanziare progetti innovativi. Infatti, è complesso trovare fondi per idee innovative in un mercato competitivo. Persino in grande aziende c'è prova di scarsità di risorse da spendere in progetti innovativi che i manager vorrebbero intraprendere. Ci sono diverse ragioni che spiegano questo fenomeno: gli attesi bassi ricavi dovuti all'incapacità di catturare i profitti di un'invenzione, l'esagerato ottimismo nell'intraprendere un investimento su progetti rivoluzionari e, in maggior misura, l'incertezza e il rischio associati a questi progetti.
Le aziende a base tecnologica possono anche imitare le invenzioni sviluppate dai concorrenti. Comunque, Edwin e altri2, usando i risultati di sondaggi, hanno trovato che l'imitazione non è senza costi e potrebbe risultare in spese dal 50% al 75% del costo dell'invenzione originale, non eliminando il problema del sottoinvestimento. I legislatori stanno tentando di cambiare la situazione del recupero di fondi, facilitando il processo inventivo, razionalizzando gli interventi attraverso l'incoraggiamento governativo delle attività innovative, sostenendo il sistema di proprietà intellettuale, consentendo incentivi fiscali per la Ricerca e lo Sviluppo e supportando le collaborazioni nelle ricerche. Nondimeno, la strada che conduce i risultati ottenuti a livello di nanoscala dal laboratorio al mercato è lunga e costosa, ponendo l'investitore in una posizione di svantaggio.
Informazione asimmetrica, credibilità e impegno
Il finanziamento e la gestione di prodotti innovativi nella nanomedicina - come in molti campi innovativi giovani e multisettoriali - avviene in un contesto di mancanza di mercato finanziario e per il prodotto. Ciò rende il finanziamento e la gestione dell'innovazione processi particolarmente complessi che sono anche riflessi nella struttura di governance aziendale delle aziende innovative.
L'informazione asimmetrica, i costi di transazione, i beni intangibili, la credibilità e problemi di impegno, congiuntamente con rischi elevati e unici, rendono impossibile per le istituzioni tradizionali di finanziamento essere parte di questo quadro, aprendo la strada a investitori informali, investitori di capitale di rischio e di avviamento e altre forme di istituzioni non tradizionali di investimento.
Il problema dell'informazione asimmetrica è parzialmente dovuto alla differente informazione disponibile per l'innovatore rispetto a quella destinata al possibile fornitore di fondi che fa sorgere "un problema di incentivo a due facce": il miglior incentivo per conciliare il comportamento conflittuale dell'imprenditore (attività inosservabili per conservare il segreto della scoperta) e del capitalista di rischio (monitoraggio dei costi) consiste nel finanziamento multistadio. In un approccio alternativo, il finanziamento a stadi risolve la mancanza di credibilità e di un adeguato impegno da parte dell'imprenditore.
I problemi della credibilità e dell'impegno sorgono perché l'imprenditore possiede un "capitale umano unico": una volta che il capitalista di rischio ha fornito il finanziamento, l'imprenditore può decidere di ritirare tale capitale umano unico e, perciò, rendere l'investitore ostaggio delle sue decisioni. In tali condizioni il capitalista di rischio non fornirebbe il finanziamento, a meno che l'imprenditore non fornisca un credibile impegno a non ritirarsi. La soluzione in questo caso è "l'impegno di capitale a stadi" simile a quando indicato da Hellman3 con una diversa ratio: il capitale umano unico degli imprenditori deve combinarsi con l'azienda in vari stadi sequenziali. Ciò conduce a un aumento progressivo del valore atteso dell'azienda (in termini di offerta pubblica iniziale futura), così che gli investimenti iniziali diventino garanzia reale (l'azienda stessa) per l'investitore di rischio, fornendo il giusto incentivo per continuare il finanziamento.
I due approcci richiedono che sia l'imprenditore sia il capitalista di rischio partecipino nella proprietà dell'azienda (e che il finanziamento avvenga in azioni) e, perciò, una strategia in evoluzione e una relazione manageriale tra le due parti in una visione evolutiva dell'azienda. Spesso il capitalista di rischio possiede molte qualità manageriali, dovute alla sua esperienza in dozzine di startup, mentre l'imprenditore innovativo ne ha poche o nessuna. Contro questo scenario, il finanziamento a stadi con azioni (per esempio la proprietà congiunta) aiuta anche ad affrontare il problema chiave delle decisioni manageriali: all'inizio della "relazione", l'imprenditore ha la conoscenza tecnica più dettagliata e i completi poteri manageriali per svolgere tutto il lavoro tecnico che deve essere effettuato in azienda. Quando questa conoscenza è trasferita all'azienda stessa, altri aspetti manageriali prendono il sopravvento (competitività, finanza, governance) in cui il capitalista di rischio ha competenze migliori. Con l'incremento della proprietà dell'investitore di rischio in stadi, i poteri manageriali possono essere trasferiti a manager nominati dall'investitore, con specifiche qualità nel condurre un'azienda startup in evoluzione e nel portarla adeguatamente sul mercato, generalmente con una IPO (n.d.t. Initial Public Offering, offerta pubblica iniziale).
A causa della significativa disapprovazione per la fornitura di fondi in supporto dell'innovazione, le aziende di nanomedicina alle prime armi non hanno un numero infinito di opzioni finanziarie. Quindi, per creare delle aziende startup, i co-fondatori impegnano in esse il proprio denaro e la propria competenza. Questo è un aspetto che rappresenta il capitale interno alla startup, all'opposto di quello esterno che deve essere ottenuto da altre fonti. A questo stadio, le aziende di nuova attivazione si rivolgono a finanziamenti governativi o a fondazioni (per esempio i programmi dei National Institutes of Health e della National Science Foundation), per finanziare la ricerca e lo sviluppo dei loro prodotti innovativi. Questi fondi sono intesi anche per proteggere la proprietà intellettuale di queste nuove scoperte e attrarre investitori professionali.
Per espandere e sostenere il proprio business, le startup nanomedicali di norma iniziano rivolgendosi a investitori informali, finanziatori privati che forniscono fondi di avviamento, poi ai capitalisti di rischio. L'interazione e il supporto di questi investitori professionali è essenziale per stimare se l'entrata sul mercato sia possibile e per decidere quale quota di mercato i diversi manager possono realisticamente raggiungere in diversi orizzonti temporali. Infatti i capitalisti di rischio entrano a uno specifico momento della vita di un'azienda quando ancora è in uno stadio embrionale, ma ha già provato fortemente il suo valore e le sue prospettive. Secondo Paul A. Gompers e Yuhai Xuan, il ruolo generale dei capitalisti di rischio è di alleviare l'informazione asimmetrica tra gli obiettivi coperti dal capitale di rischio privato e gli acquirenti pubblici, costruendo un ponte tra le due parti.
Questi fondi servono per pianificare decisioni d'investimento così da diminuire i possibili costi che affliggono le giovani aziende imprenditoriali. Di solito i capitalisti di rischio aggiungono valore alle aziende in cui investono oltre il finanziamento puro, fornendo competenza manageriale, esperienza industriale, contatti e - non ultimo - slancio. C'è forte evidenza del coinvolgimento di capitalisti di rischio nel management di aziende di nanotecnologia finanziata dall'esterno poiché esse spesso hanno costi più alti e tempi di sviluppo più lunghi in comparazione con business del settore dell'information tecnology, per esempio, fattori che aumentano il rischio di investimento e che quindi attraggono più facilmente capitalisti che per professione sono disposti a finanziare attività maggiormente rischiose, assumendosene gli oneri finanziari in cambio degli alti profitti in caso di successo. In aggiunta, Baker e Gompers4 asseriscono che le aziende appoggiate da capitale di rischio hanno consigli di amministrazione migliori se comparati con quelle non finanziate da capitalisti di rischio. Questa evidenza conferma il ruolo cruciale giocato da questo tipo di capitalisti nel successo economico dei prodotti basati sulla nanomedicina.
Strategia d'affari

Una delle molte applicazioni delle nanomolecole con qualità uniche: canale termosensibile a idrogel nanotecnologico, usato sia in medicina sia in meccanica.
L'area di business principale che caratterizza un'azienda di nanomedicina, come pure le industrie biotecnologiche, è la ricerca e lo sviluppo (R&D). Per scegliere la strategia R&D, i manager valutano due possibili opzioni. La prima è basata sull'idea di compiere l'intero processo all'interno dell'azienda, componendo una squadra di scienziati altamente esperti. La seconda opzione si basa sulle università o gli istituti di ricerca ed è fondata sull'affidamento a massimi laboratori accademici creati nel tempo da "star scientifiche". Questa seconda possibilità ridurrà certamente i costi aziendali poiché questi accademici frequentemente co-fondano le aziende basate sulle loro scoperte e divengono parte dei loro consigli scientifici. Si è raccolta solida prova di questa seconda opzione per la strategia R&D nelle aziende che abbiamo analizzato. La commercializzazione dei prodotti basati sulla ricerca potrebbe rappresentare un'altra area d'affari dell'azienda di nanomedicina. Tuttavia, l'opzione tipica considerata e adottata dai manager è licenziare la manifattura e la commercializzazione dei prodotti basati sulla nanomedicina ad aziende più grandi. In questo caso, il modello di business perseguito non includerà la commercializzazione e la compagnia sarà basata solo sulla ricerca e la tecnologia.
La commercializzazione di prodotti/tecnologie nanomedicali è condotta attualmente da startup e imprese medio-piccole (SME) ed è compiuta attraverso tre tipi di modelli d'affari.
- Lo sviluppo di una piattaforma nanotecnologica che può essere usata per aggiungere valore a prodotti di seconde parti: questo modello di business sembra essere particolarmente attrattivo per le aziende di somministrazione di medicinali che tipicamente licenziano le loro particolari tecnologie a industrie farmaceutiche. In alternativa, il sistema di somministrazione di medicinali è personalizzato e applicato a medicinali specifici conformi alle istruzioni particolari impartite dalle aziende più grandi;
- lo sviluppo e la manifattura di materiali d'alto valore per l'industria farmaceutica e di apparecchiature medicali: molte startup e SME forniscono semplicemente nanomateriali per la manifattura di apparecchiature medicali o medicinali migliorati con nanotecnologia;
- lo sviluppo di apparecchiature medicali o farmaci migliorati con nanotecnologia: le aziende che adottano questo modello di business intendono sviluppare una pianificazione per un prodotto proprietario come pure portare sul mercato medicinali nuovi o standard con un sistema di somministrazione o altro in modo da sviluppare, per esempio, una nuova piattaforma diagnostica basata sulle nanotecnologie.
Rischi regolatori
La lunga procedura d'approvazione della US Food and Drug Administration (FDA) e le norme regolatrici fanno dei prodotti nanomedicali prodotti differenti da quelli di altre industrie che usano le nanotecnologie senza limitazioni dovute a corpi normativi. Come conseguenza, la spesa per portare un prodotto nanomedicale sul mercato è tanto enorme che le industrie farmaceutiche e biotecnologiche non hanno altra alternativa se non focalizzarsi su sicuri successi commerciali che possano soddisfare gli azionisti. Le nanoparticelle non sono inevitabilmente rischiose, ma hanno proprietà uniche che mettono in questione la loro sicurezza. È ragionevole presumere che i nanomateriali siano "nuovi e debbano essere valutati a scopo di sicurezza"5 e perciò meritino attenti controlli regolatori da parte della FDA prima e dopo l'entrata sul mercato. In questo scenario, le agenzie federali come la FDA e lo US Patent and Trade Mark Office (PTO) impongono una sorta di ordine, per la protezione della popolazione, mentre incoraggiano lo sviluppo di questi prodotti.
L'avvento della nanomedicina, oltre a causare cambiamenti nel modello di business e nella catena di valore delle industrie biofarmaceutiche, ha portato due cruciali problemi regolatori: le difficoltà nella classificazione del prodotto e una mancanza di competenza scientifica da parte della FDA.
Sulla base del metodo d'azione principale del prodotto, la FDA classifica i nanoprodotti come medicinali, dispositivi o combinazione di entrambi. A fini regolatori, la FDA applica gli stessi requisiti a ogni parte del prodotto composto e verifica se il fabbricante ha dato la definizione corretta del prodotto. La definizione diviene estremamente ambigua per nuovi dispositivi di somministrazione per medicinali basati su nanotecnologia poiché essi possono essere considerati sia dispositivi (vettori) sia medicinali (effettori). La FDA affronterà sfide eccezionali nel regolare efficacemente tali prodotti. Per riuscirci, è essenziale una notevole conoscenza scientifica del campo unita a una migliore comprensione del potenziale rischio associato all'esposizione dei pazienti ai prodotti nanomedicali.
Prassi migliori in ambito clinico
Portare nuovi prodotti sul mercato ha sempre rappresentato una grande sfida, specialmente quando si arriva a prodotti altamente innovativi ad alto rischio/alto profitto. Nonostante le numerose barriere all'entrata sul mercato della nanomedicina, ci sono notevoli esempi di prodotti basati sulla nanotecnologia approvati dalla FDA che hanno raggiunto con successo il mercato, avendo impatto sulla medicina e anticipando un cambiamento nell'ambito dell'assistenza sanitaria.
All'interno del segmento dei prodotti anticancro, il Doxil e l'Abraxane sono due dei principali esempi di successo in ambito clinico. La Sequus Pharmaceuticals è stata la prima azienda a vendere il Doxil, la formulazione liposomica della Doxorubicina, un potente ma tossico chemioterapico, inizialmente approvato per il trattamento del sarcoma di Kaposi negli USA nel 1995. La Sequus fu poi acquistata nel 1998 dalla ALZA Pharmaceutical per 580 milioni di dollari la quale successivamente si fuse con la Johnson and Johnson nel 2001 in un accordo da 12.3 miliardi di dollari. L'altro agente nanoterapico, l'Abraxame, invece fu originariamente venduto dall'Abraxis Biosciences che fu acquistata nel giugno 2010 dalla Celgene Corporation per 2.9 miliardi di dollari.
Questo prodotto consiste di nanoparticelle di albumina contenenti paclitaxel ed è indicato per il trattamento del cancro al seno. La chemioterapia convenzionale consiste di iniezioni intravenose di medicinali citotossici che uccidono indiscriminatamente le cellule tumorali e quelle sane. Il successo clinico del Doxil e dell'Abraxane fu dovuto alla loro abilità di concentrarsi di preferenza nei tumori, a causa delle fessure (altrimenti chiamate fenestrature endoteliali) caratterizzanti i vasi sanguigni che irrorano la massa cancerosa. Nanoparticelle della giusta dimensione possono penetrare questi "cancelli" e diffondersi passivamente nei tumori. Grazie a questa generazione di chemioterapici, i pazienti possono ora beneficiare di nuove strategie di trattamento per la somministrazione di medicinali attraverso vettori nanotecnologici con minore tossicità sistemica ed efficacia terapeutica migliorata.
Il successo economico di questi prodotti nanomedicali è dovuto all'urgente richiesta di nuove terapie anticancro capaci di combattere meglio queste malattie altamente aggressive e di crescente frequenza. Infatti, il problematico processo regolatore della FDA, la precaria situazione dei finanziamenti e il costoso e lungo processo R&D non hanno impedito lo sviluppo e il successo del Doxil e dell'Abraxane.
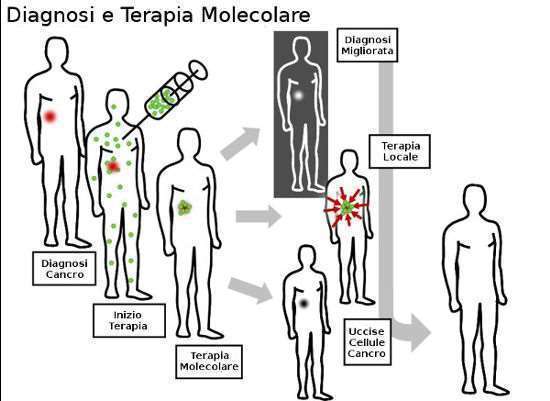
Rappresentazione diagnosi e terapia molecolare anticancro mirata.
Sebbene siano i più profittevoli, i sistemi di somministrazione anticancro non sono i soli prodotti nanomedicali clinicamente approvati. Infatti, progressi nella nanomedicina hanno portato a svolte in altre aree problematiche della medicina. Di seguito sono riportati esempi di prodotti nanomedicali attivati da nanotecnologia di successo e presenti sul mercato.
La prima applicazione di successo di nanoparticelle in ambito clinico fu l'Omniscan, il prodotto iniettabile di punta per la risonanza magnetica della Amersham. Questo agente di contrasto fu approvato per la risonanza magnetica (MRI), lanciato nel 1993 e utilizzato da allora sia in neurologia, per identificare gli ictus e i tumore cerebrali, sia in cardiologia.
Lo stesso agente di contrasto, originariamente sviluppato da Salutar, ha un prolungato tempo di dimezzamento nei pazienti con insufficienza renale. Dopo la conduzione dei test preclinici, la Salutar fu acquisita da Nycomed che in cambio comprò Amersham International, nel 1997.
Attualmente, Amersham e i suoi diritti sull'Omniscan sono proprietà della General Electric Healthcare. L'accordo fu concluso nel 2003 per 9,5 miliardi di dollari per una transazione sul 100% delle azioni. Secondo Yan e altri6, come confermato da Spiess7, ci sono 12 differenti agenti di contrasto per risonanza magnetica ora sul mercato. Il Magnevist fu commercializzato da Bayer Schering Pharma come primo agente di contrasto intravenoso utilizzato in ambito clinico. Nel 2004 l'azienda dimostrò che il prodotto facilitava in sicurezza ed efficacemente la visualizzazione dell'anatomia cranica e vertebrale tra cancri e lesioni, e da allora è diffuso a livello mondiale per quello specifico uso. Infine, MultiHance è il primo agente di contrasto fluido extracellulare che si presenta in interazione con le proteine del plasma. Il Bracco Group, un'azienda italiana specializzata in diagnostica visiva, lo produce ed è utilizzato nella MRI diagnostica del fegato e del sistema nervoso centrale. Fu lanciato in Europa nel 1998 e ricevette l'approvazione dell'FDA per la commercializzazione del prodotto negli Stati Uniti nel 2004.
Ritornando al segmento delle applicazioni farmaceutiche della nanomedicina, è importante ricordare due medicinali basati sulle nanoparticelle, approvati dalla FDA e usati per il trattamento di gravi infezioni fungine: AmBisome (liposoma per iniezione), venduto da Gilead Sciences e Fujisawa Healthcare, e l'Abelcet (lipide complesso), commercializzato dalla Elan Corporation.
La formulazione liposomica dell'anfotericina B (AmBisome, nel suo nome commerciale) fu originariamente uno dei medicinali più profittevoli della NeXstar Pharmaceuticals. L'azienda, con il suo portafoglio di prodotti, fu poi acquisita da Gilead nel marzo 1999. Per quel che riguarda l'Abelcet (la tradizionale amfotericina B), i suoi diritti per il Nord America furono acquistati dalla Enzon Pharmaceuticals nel 2002, in un accordo operativo e profittevole da 360 milioni di dollari (comprendente strutture e asset operativi relativi allo sviluppo, produzione e vendita del medicinale). Il farmaco fu impiegato nel trattamento di pazienti con infezione fungina aggressiva associata al cancro, trapianto di organi e altre complicazioni postoperatorie. Vogliamo enfatizzare questi due prodotti specifici anche perché essi sono stati oggetti di uno "studio farmaeconomico". Come risultato dell'analisi che coinvolgeva i due farmaci nel trattamento empirico di pazienti persistentemente neutropenici e febbricitanti con presunta infezione fungina, l'AmBisome è stato ritenuto più efficace dal punto di vista economico rispetto all'Abelcet.
Alla luce di questa visione d'insieme delle migliori pratiche in ambito clinico, il segmento anticancro rappresenta la quota più grande del mercato nanomedicale, oltre che per numero di pubblicazioni e brevetti, anche per numero di prodotti commercializzati. La crescente accettazione da parte del pubblico dell'impiego di nanotecnologie in ambito clinico insieme alla sensibilità popolare diffusa sull'aggressività del cancro possono essere considerate forti guide per il successo commerciale di questo segmento. Inoltre, i primi considerevoli e tangibili profitti dovuti ai trionfi commerciali rappresentano un'indubbia fonte di attrazione per gli investitori. Da parte loro, i finanziatori devono realizzare l'importanza di fornire fondi in maniera sostanziale, necessari per ottenere risultati solidi e medicinali di successo, come pure tecniche e terapie che il mercato richiede.
Gli investimenti effettivi sul Doxil e l'Abraxane, come su altri prodotti di successo citati, sono i primi esempi di questa buona pratica.
Conclusioni e future promesse
Nonostante i problemi che la nanomedicina deve ancora affrontare, gli investimenti in questo mercato sono previsti in crescita. Nuove applicazioni della nanomedicina sono state illustrate e l'espansione risultante del mercato potenziale rende il rischio più appetibile.
Il feroce collasso finanziario ha elevato i costi sommersi del processo essenziale R&D. Il complicato accesso ai finanziamenti, l'incertezza dei profitti attesi e l'estremamente meticoloso e lungo processo regolatore della FDA non hanno però scoraggiato la comunità degli investitori. D'altra parte, le promesse di grandi sviluppi potenziali futuri in diversi segmenti di mercato ad alti profitti connessi all'alto rischio degli investimenti sull'innovazione hanno reso questo mercato considerevolmente attraente. Comparato al campione del 2007, i capitalisti di rischio nel 2009 hanno deciso di raddoppiare i loro investimenti nel settore, a spese del mercato informatico. Il fatto che la nanomedicina domini i finanziamenti del capitale di rischio nel mercato dell'assistenza sanitaria è sicuramente un buon segnale di un luminoso futuro di espansione di questa promettente area di ricerca.
Inoltre, i buoni profitti possono persino essere il risultato di più accurate valutazioni dei rischi d'investimento. Un'analisi farmaeconomica permetterebbe l'efficiente allocazione delle risorse monetarie e la massimizzazione dei ricavi sanitari con costi più bassi. Un'analisi costi-benefici è strutturata con la comparazione dei costi e degli effetti di due o più trattamenti che sono sotto esame. Sebbene nei primissimi stadi del ciclo di sviluppo di un medicinale l'alto tasso di fallimento delle nuove molecole è largamente dovuto a un non adeguato indice terapeutico, nella fase di sviluppo clinico questo tasso origina da ragioni economiche. Perciò, lo sviluppo di medicinali di scarso successo deve essere abbandonato molto presto, così da risparmiare risorse per composti più promettenti. Questo risparmio è ottenuto attraverso una valutazione economica accurata nei primi stadi del processo di sviluppo. Il punto di riferimento è rappresentato dagli anni-vita salvati dalla nanoterapia su cui si sta investigando; se la terapia a livello nanometrico non salva sufficienti anni-vita per essere in pareggio economico, non dovrebbe essere sviluppata oltre.
Il maggior limite al successo di questo tipo di analisi è dato dalla scarsità di dati clinici riguardanti la nanomedicina. La migliore soluzione a questo problema è la collaborazione. Secondo Bosetti e Vereeck8, gli economisti e gli investitori specializzati nel mercato sanitario dovrebbe lavorare a stretto contatto con i fornitori dell'assistenza sanitaria, i ricercatori, le associazioni di pazienti, i dottori, i tecnici di tutti i tipi, per creare una piattaforma condivisa capace di facilitare la comunicazione tra le parti con lo scopo finale di ridurre gli alti rischi di investimento nella nanomedicina. Come risultato, anche i pazienti beneficeranno di questi investimenti, in termini di tecniche innovative, terapie, attrezzature e medicinali progettati per prolungare e migliorare le loro vite.
Note
1 - BCC Research, "Nanotechnology in Medical Applications: The Global Market", 2010.
2 - M. Edwin, M. Schwartz, e S. Wagner, "Imitation costs and patents: an empirical study", Economic Journal, vol. 91, pp. 907-918, 1981.
3 - T. Hellmann, "The allocation of control rights in venture capital contracts", RAND Journal of Economics, vol. 29, no. 1, pp. 57-76, 1998
4 - M. Baker e P. A. Gompers, "The determinants of board structure at the initial public offering", Journal of Law and Economics, vol. 46, no. 2, pp. 569-598, 2003
5 - T. Flynn e C. Wei, "The pathway to commercialization for nanomedicine", Nanomedicine: Nanotechnology, Biology, and Medicine, vol. 1, no. 1, pp. 47-51, 2005.
6 - G. P. Yan, L. Robinson, e P. Hogg, "Magnetic resonance imaging contrast agents: overview and perspectives", Radiography, vol. 13, no. 1, pp. e5-e19, 2007
7 - R. Spiess, "Magnetic nanoparticles as contrast agents for MRI", 2011
8 - R. Bosetti e L. Vereeck, "Future of nanomedicine: obstacles and remedies", Nanomedicine, vol. 6, no. 4, pp. 747-755, 2011
Copyright
Questo articolo è distribuito sotto la licenza Creative Commons Attribution License. Traduzione e adattamento italiano: © 2013 Gianluca Turconi.
Copyright © 2006-2025 Gianluca Turconi - Tutti i diritti riservati.
